Entzündlich rheumatische Erkrankungen
Rheumatoide Arthritis
Die rheumatoide Arthritis – im deutschsprachigen Raum auch chronische Polyarthritis genannt – ist die häufigste entzündliche Gelenkserkrankung. Ungefähr 1% der Bevölkerung leidet an einer rheumatoiden Arthritis, Frauen sind ca. dreimal häufiger als Männer betroffen. Die Erkrankung kann in jedem Alter auftreten, zeigt sich allerdings meistens zwischen dem 35. und 45. Lebensjahr das erste Mal. Wenn Kinder erkranken, wird dies als juvenile idiopathische Arthritis bezeichnet.
Ursachen:
Die rheumatoide Arthritis ist eine sogenannte Autoimmunerkrankung – hierbei attackiert das Immunsystem fälschlicherweise anstatt äußeren Bedrohungen (wie z.B. Viren und Bakterien) Teile des eigenen Körpers. Im Falle der rheumatoiden Arthritis kommt es dadurch zu Entzündungen der Gelenke und gelenksnaher Strukturen (z.B. Sehnenscheiden oder Schleimbeutel). Auch andere Organe wie Lunge, Herz, Gefäße, Augen oder die Haut können betroffen sein. Warum das Immunsystem den eigenen Körper attackiert ist bis heute nicht genau geklärt. Eine Kombination aus genetischen Faktoren sowie Umwelteinflüssen (z.B. Infektion durch bestimmte Viren und Bakterien) scheint eine Rolle zu spielen. Auch Rauchen erhöht das Risiko, an einer rheumatoiden Arthritis zu erkranken, zudem sprechen die Therapien bei Rauchern oft schlechter an.
Symptome:
Es kommt zu schmerzhaften Schwellungen vor allem an den Finger- und Zehengelenken, welche symmetrisch- sprich an beiden Körperhälften – auftreten. Entzündliche Gelenksbeschwerden treten typsicherweise in der Nacht und in Ruhe auf und werde bei Belastung besser – im Gegensatz zu den ebenfalls häufig vorkommenden Arthrosen (altersbedingte Abnützung der Gelenke), welche bei Belastung schlechter werden. Bei einer rheumatoiden Arthritis sind die Symptome zumeist morgens am stärksten ausgeprägte, es kommt zu einer Morgensteifigkeit, welche zumindest 60 min anhält, durch die Gelenksschwellungen ist dann oft ein Faustschluss kaum möglich. Zusätzlich kann es zu Allgemeinsymptomen wie Abgeschlagenheit, Fieber, ungewollter Gewichtsverlust oder Nachtschweiß kommen. Sollten innere Organe wie z.B. Herz oder Lunge betroffen sein, kann sich dies in Symptomen wie Luftnot, verminderte Leistungsfähigkeit oder Husten äußern.
Diagnose:
Wichtig ist eine frühe Diagnose, um mögliche Langzeitfolgen zu verhindern. Im ersten Schritt erfolgt die Erhebung der Krankheitsgeschichte und der beschriebenen typischen Symptome. Zur weiteren Abklärung erfolgen Blutuntersuchungen – wichtig sind hierbei die Entzündungswerte, das C-reaktive Protein (CRP) und die Blutsenkungsgeschwindigkeit (BSG). Der sogenannte Rheumafaktor (RF) ist bei 70-80% der Patienten positiv, kann aber auch bei diversen anderen Erkrankungen oder auch gesunden Menschen (10-25% der Menschen >70 Jahre) auftreten. Antikörper gegen cyclische citrullinierte Peptide (ACPA oder CCP-AK genannt) sind typischer für die Rheumatoide Arthritis und somit weniger oft bei anderen Erkrankungen nachweisbar, allerdings bei nur etwa 50-70% der Patenten tatsächlich positiv. Bildgebende Verfahren wie Röntgen, Ultraschall oder eine Magnetresonanztomografie (MRT) können zusätzlich Informationen über den aktuellen Zustand der Gelenke und das Ausmaß der bereits bestehenden Gelenkszerstörung liefern.
Therapie:
Ziel der Behandlung ist im Idealfall die vollständige Unterdrückung der Krankheitsaktivität (= Remission). Schmerzmittel aus der Gruppe der sogenannten „nicht-steroidalen Antirheumatika“ (NSAR, z.B. Ibuproden oder Diclofenac) sowie Kortison erreichen bei Krankheitsbeginn und akuten Schüben in der Regel rasch eine Unterdrückung der Entzündung, sind aber aufgrund der vielen Nebenwirkungen in der Langzeittherapie ungeeignet. Der erste Schritt in der Dauertherapie sind die sogenannten Basismedikamente (auch DMARDs = disease-modifying anti-rheumatic drugs), welche die Entzündungsreaktion langfristig unterdrücken, der Wirkeintritt ist jedoch in der Regel erst nach einigen Wochen zu beobachten. Das am häufigsten eingesetzte Medikament ist Methotrexat bzw. Ebetrexat, andere Vertreter sind Leflunomid, Sulfasalazin oder Hydroxychloroquin. Sollten diese nicht ausreichend die Krankheitsaktivität beherrschen, werden im nächsten Schritt sogenannte Biologika eingesetzt. Dies sind biotechnologisch hergestellte Eiweißmoleküle, welche Teile des Immunsystems unterdrücken und je nach Substanz in wöchentlichem bis monatlichem Abstand unter die Haut gespritzt werden. Eine neue Substanzklasse sind die Januskinase-Hemmer (JAK-Inhibitoren), welche direkt in der Immunzelle wirken und als Tablette eingenommen werden.
Weitere Infos:
- Neben der medikamentösen Therapie sind Physio- und Ergotherapie zum Training der Muskeln und Entlastung der Gelenke wichtig.
- Eine psychologische Betreuung zur Hilfe bei der Krankheitsbewältigung kann ebenfalls unterstützend wirken.
- Veränderungen des Lebensstils inklusive gesunder Ernährung und vor allem das Abgewöhnen vom Rauchen wirkt sich ebenfalls positiv auf den Krankheitsverlauf aus.
- Operationen von bereits zerstörten Gelenken können unter bestimmten Voraussetzungen durchgeführt werden, sind aber aufgrund der vielen modernen Therapiemöglichkeiten heutzutage immer seltener notwendig.
Axiale Spondyloarthritis
Ursache:
Es handelt sich um eine immun-mediierte entzündlich rheumatische Erkrankung, die zu einem Großteil auch genetisch determiniert ist. HLA-B27 ist ein Molekül des Major Histokompatibilitätskomplexes und findet sich bei bis zu 95% der Patienten. Eine genaue Ursache für die Auslösung der Erkrankung ist nicht bekannt, Infektionen und Umwelteinflüsse in Kombination mit einer genetischen Neigung werden vermutet.
Symptome:
Typischerweise treten die ersten Symptome zwischen dem 15. und 40. Lebensjahr auf. Entzündliche Rücken- und alternierende Gesäßschmerzen sind die häufigsten Frühsymptome.
Der entzündliche Rückenschmerz zeigte sich bei bis zu 80% der Patienten und ist somit das häufigste Symptom. Er wird durch folgende Kriterien definiert:
- Beginn des chronischen Rückenschmerzes (= Dauer mindestens 3 Monate) vor dem 40. Lebensjahr
- Schleichender Beginn der Rückenschmerzen
- Besserung der Rückenschmerzen durch Bewegung
- Keine Besserung der Rückenschmerzen in Ruhe
- Schmerzen in der Nacht (mit Besserung beim Aufstehen aus dem Bett)
Bei bis zu 50% der Patienten kann auch eine Arthritis auftreten, dabei sind bevorzugt die großen Gelenke der unteren Extremität (Hüft-, Knie-, und Sprunggelenke) betroffen. Zusätzlich zeigen sich auch Sehnenansatzentzündungen (=Enthesitis), am häufigsten im Bereich der Ferse (Achillessehne), aber auch am Beckenkamm, am Hüftkopf, im Bereich der Kniegelenke und an der vorderen Thoraxwand (Sternocostalgelenke).
Weiters können auch Organe mitbetroffen sein:
- Augen (zumeist einseitige Uveitis)
- Haut (Psoriasis)
- Darm (chronisch entzündliche Darmerkrankungen wie M. Crohn und Colitis ulcerosa)
Diagnose:
Die axiale Spondyloarthritis kann in eine Frühform (nichtradiographische) und in eine sich daraus entwickelnde radiographisch Form unterteilt werden.
Bei der nichtradiographischen (= unauffälliges Skelettröntgen) Spondyloarthrits wird zur Diagnose eine MRT der Sacroiliacalgelenke und Wirbelsäule (je nach Symptomatik LWS und thorakolumbaler Übergang) durchgeführt, wo sich entsprechende Veränderungen (Knochenmarksödeme) als Ausdruck der akuten Entzündung finden.
Bei der radiographischen Spondyloarthritis finden sich bereits in den Skelettröntgen entzündliche Veränderungen als Ausdruck der langjährig bestehenden Grunderkrankung. Bei Voranschreiten der entzündlichen Veränderungen kommt es dann zu Verknöcherungen und Ankylosen, die zu einer zunehmenden Versteifung und Bewegungseinschränkung führen können.
Laboruntersuchungen:
Bestimmung von HLA-B 27 und Entzündungsparameter (CRP und Blutsenkung). Die Entzündungsparameter sind bei aktiver Erkrankung meist nur gering erhöht und bei bis zu 50 % der Patienten auch negativ.
Während die nicht-radiographische axiale Spondyloarthritis bei Männern und Frauen gleich häufig vorkommt, sind Männer von einer radiographischen axialen Spondyloarthritis häufiger betroffen als Frauen.
Therapie:
NSAR sind aufgrund ihrer entzündungshemmenden Wirkung die Basis der medikamentösen Therapie und sind bei bis zu 60% der Patienten auch sehr gut wirksam. Ihr Einsatz wird vor allem während aktiver Krankheitsphasen zur Symptomkontrolle empfohlen, auf Grund ihres Nebenwirkungsrisikos sollte eine Dauertherapie nur bei anhaltenden Symptomen durchgeführt werden. Bei fehlendem Ansprechen auf ein NSAR nach einer Therapie von 2 Wochen in voller Dosis sollte auf ein anderes gewechselt werden.
Ist auch damit keine ausreichende Unterdrückung der Krankheitsaktivität erreicht sollte dann eine Therapie mit Biologica (TNF-Blocker, IL-17-Blocker, Januskinase-Inhibitoren) begonnen werden.
Die konventionellen DMARDs (= Disease-Modifying Antirheumatic Drugs) wie Sulfosalazin, Leflunomid und Methotrexat haben keine Wirkung auf die entzündliche Symptomatik der Wirbelsäule, sie können aber bei peripheren Gelenksentzündungen im Bedarfsfall eingesetzt werden.
Regelmäßige Gymnastik gehört zur Basis jeglicher Behandlung, um Schmerzen und Steifigkeit zu vermindern und möglichst lange eine Einschränkung der Beweglichkeit zu verhindern.
Wertvolle Infos:
- Wie bei allen entzündlichen rheumatischen Erkrankungen ist auch bei der axialen Spondyloarthritis die frühe Diagnose und entsprechende Therapieeinleitung sehr wichtig, um entzündliche Veränderungen und daraus resultierende Bewegungseinschränkungen zu verhindern.
- HLA-B 27 ist als Suchtest nicht geeignet, da auch ca. 6-9% der gesunden Bevölkerung Träger dieses Gens sind und ein fehlender Nachweis eine axiale Spondyloarthritis nicht ausschließt.
- Bei positiver Familienanamnese ersten Grades einer Spondyloarthritis (axSpA, Psoriasis, CED, Uveitis) und zusätzlich bestehender, typischer Symptome des Betroffenen sollte umgehend eine rheumatologische Abklärung veranlasst werden.
Komorbiditäten:
Betroffene Patienten haben ein erhöhtes Risiko für:
- Osteoporose
- kardiovaskuläre Komplikationen
- psychische Begleiterkrankungen zeigen sich als Depressionen und Angststörungen.
Psoriasis Arthritis
Psoriasis Arthritis (= PsA):
Die PsA wird in die Gruppe der Spondyloarthritiden eingeordnet, weil das pathophysiologische Konzept der Enthesitis (= Sehnenansatzentzündungen) auch bei der PsA zu finden ist und bei bis zu 20 % der PatientInnen ein entzündlicher Rückenschmerz und bei bis zu 40 % der PatientInnen mit PsA radiologische Veränderungen im Sinne einer Spondylitis auftreten.
Bis zu 30% der Patienten mit Psoriasis werden auch eine PsA entwickeln, wobei die Möglichkeit einer Neuerkrankung zeitlich nicht limitiert ist.
PatientInnen mit Befall der Kopfhaut, Nagelbefall, Psoriasis inversa und Befall des Genitalbereiches haben dahingehend ein weiter erhöhtes Risiko.
Symptome:
Im Durchschnitt entwickelt sich die PsA mit zwei Altersgipfeln um das 30. und 50. Lebensjahr etwa 10 Jahre nach Auftreten der Psoriasis.
In 15–30 % der Fälle wird die Psoriasis aber erst nach der Entwicklung der PsA manifest (PsA ohne Psoriasis).
Es wurden fünf Verlaufsformen beschrieben, in denen alle klinischen Erscheinungsformen enthalten sind:
- transversaler Befall der distalen Interphalangealgelenke (DIPs)
- asymmetrischer oligoartikulärer Befall (= wenige, das heißt 1-4 betroffene Gelenke)
- einen der rheumatoiden Arthritis ähnlichen symmetrischen polyartikulären Befall
- eine Spondylitis (Entzündung der Wirbelsäule)
- Arthritis mutilans
Die genannten Verlaufsformen liegen im klinischen Alltag oft als Mischform vor.
Die rasch progredient destruierend verlaufende Arthritis mutilans ist erfreulicherweise selten und tritt nur bei 2–16 % der PatientInnen auf.
Im klinischen Alltag kann sich die PsA aber auch nur mit Enthesitiden (= Sehnenansatzbeschwerden) und/oder Daktylitiden (= wurstförmig geschwollene Zehen oder Finger) präsentieren. Viele PatientInnen mit PsA leiden an einer Nagelpsoriasis, die manchmal nur gering ausgeprägt ist.
PatientInnen mit einer hohen Aktivität der Psoriasis haben ein erhöhtes Risiko für die Entwicklung einer PsA.
Diagnose:
Klinischer Status und ausführliche Anamnese inklusive Familienanamnese.
Apparative Diagnostik mittels Sonographie, Skelettröntgen und MRT (insbesondere bei Verdacht auch Skelettmitbeteiligung).
HLB-27 ist nur bei circa 30% der PatientInnen positiv, erhöhte Entzündungsparameter (CRP) bei bis zu 30% der PatientInnen unauffällig, es finden sich keine erhöhten Autoantikörper (RF oder CCP neg.).
Therapie:
Für PatientInnen mit axialer Beteiligung können als Basistherapie NSAR eingesetzt werden, ebenso bei Pat. mit Oligoarthritis ohne prognostisch negative Faktoren.
Bei peripherer Arthritis oder extraartikulären Manifestationen sollte frühzeitig die Therapie mit einem synthetischen DMARD begonnen werden.
Methotrexat ist bei relevanter Hautbeteiligung zu bevorzugen.
Bei PsA ohne prognostisch negativen Faktoren kann im Falle des Therapieversagens
ein anderes konventionelles synthetisches DMARD zum Einsatz kommen, wie zum Beispiel Leflunomid, Sulfasalazin oder (nur mehr sehr selten eingesetzt) Cyclosporin A.
Kortikosteroide können zusätzlich lokal (vor allem intraartikular) appliziert werden,
systemisch nur in möglichst geringer, gerade noch wirksamer Dosis.
Bei PatientInnen, die auf zumindest ein konventionelles DMARD nicht angesprochen
haben, kommen Biologica in Betracht (TNF-Blocker, IL 17-Blocker, IL 12/23-Blocker, IL 23 Blocker, PDE4-Hemmer, JAK-Inhibitoren).
Ergotherapie und physiotherapeutische Maßnahmen sollen unterstützend eingesetzt werden.
Parameter einer schlechten Prognose bei PatientInnen mit Psoriasisarthritis und peripherer Manifestation:
- Befall von fünf oder mehr Gelenken
- Radiologische Progression der Erkrankung
- Funktionsverlust
- Verlust an Lebensqualität
- Vorangegangener Glukokortikoid Gebrauch
- hohe Entzündungsparameter
- Nikotinabusus
Wertvolle Infos:
Die PsA ist ebenso wie die Psoriasis vulgaris häufig mit Komorbiditäten assoziiert.
Die häufigsten Komorbiditäten sind:
- Osteoporose
- Arterielle Hypertonie mit all ihren Folgen
- Adipositas
- Diabetes mellitus Typ 2
- Metabolisches Syndrom
- Fettleber
- Depression
- Angststörungen
Reaktive Arthritis
Ursache:
Die ReSpA entwickelt sich typischerweise zwischen dem 30. und 40. Lebensjahr
1–4 Wochen nach einem vorwiegend urogenitalen oder intestinalen Infekt.
Chlamydia trachomatis, Salmonella enterica, Campylobacter jejuni, Yersinia enterocolica und pseudotuberculosis und Shigella spezies gelten als gesicherte Auslöser einer ReSpA.
Symptome:
Die PatientInnen entwickeln bevorzugt eine Oligoarthritis der großen
Gelenke an den unteren Extremitäten. Es kann jedoch auch eine Polyarthritis mit
Befall kleiner Gelenke der oberen Extremitäten auftreten.
Zudem können Enthesitiden (= Sehnenansatzbeschwerden), Bursitiden (= Schleimbeutelentzündungen) und ein Befall des Achsenskelettes isoliert oder zusammen mit einer Arthritis vorliegen.
Bei etwa 30 % der PatientInnen kommt es zu Organmitbeteiligungen:
der Augen (Konjunktivitis, seltener Uveitis anterior) und
der Haut (Erythema nodosum, Balanitis circinata, Keratoderma blenorrhagicum, Mundulcera Pyoderma gangränosum).
Eine sterile Urethritis oder Cervicitis, ein AV-Block, eine Myo-/Perikarditis oder eine Glomerulonephritis sind sehr seltene Symptome einer ReSpA.
Klinische Erfahrungen zeigen, dass sich im Gegensatz zu den übrigen Spondyloarthritiden bei der ReSpA gehäuft hoch pathologische Entzündungsparameter und eine Entzündungsanämie finden.
Diagnose:
Klinischer Status und ausführliche Anamnese.
Versuch eines Keimnachweises mittels Urethralabstrich, Stuhlkultur, Gelenkspunktion, Blutserologie.
HLA-B27 ist nur bei circa 12% der PatientInnen positiv.
Sonographie der betroffenen Gelenke, Skelettröntgen aufgrund der kurzen Krankheitsdauer üblicherweise unauffällig, MRT bei Verdacht auf Wirbelsäulenmitbeteiligung.
Therapie:
Wird eine aktuelle Infektion durch einen auslösenden Erreger nachgewiesen (z.B.
direkter Keimnachweis mittels Kultur oder PCR), sollte eine gezielte antibiotische
Therapie erfolgen.
Bei einer Infektion mit Chlamydia trachomatis sind Azithromycin und Doxycyclin Mittel der ersten Wahl, wobei Partner der PatientInnen mitbehandelt werden müssen. Infektionen mit Chlamydia pneumoniae sprechen auf die Gabe von Makroliden, Doxycyclin und Fluorchinolonen an.
Eine intestinale Infektion ist selbstlimitierend und braucht nicht antibiotisch behandelt zu werden.
Die Therapie der akuten ReSpA ist symptomatisch und besteht aus der Gabe von
NSAR in hoher Dosis, lokalen Kortison Injektionen, Kryotherapie und Bewegungsübungen der betroffenen Regionen.
Bei Polyarthritiden und hoher Entzündungsaktivität sowie extraskelettalen Manifestationen (Haut oder Augen) ist oft eine höherdosierte Kortisontherapie erforderlich.
Für eine antibiotische Therapie der akuten ReSpA (und fehlender aktiver
Infektion) liegen insgesamt widersprüchliche Studienergebnisse vor, sodass
derzeit keine antibiotische Therapie empfohlen wird.
Da mindestens die Hälfte der ReSpAs innerhalb von 6 Monaten abklingen und eine
immunsuppressive Therapie bei intraartikulär nachweisbarer bakterieller DNA theoretisch zu einem Wiederaufflammen der Infektion führen kann, wird eine DMARD-Therapie erst bei chronischen Verläufen über 6 Monate begonnen.
Auf Grund der Studienlage wird Sulfasalazin als Mittel der ersten Wahl angesehen. Bei ungenügender Wirksamkeit von Sulfasalazin wird auch Methotrexat eingesetzt.
Bei therapierefraktären Verläufen ist aufgrund der Studienlage ein Versuch mit TNF-Blockern gerechtfertigt, obwohl bei intrazellulärer Persistenz von Chlamydia trachomatis theoretisch eine Exacerbation der Infektion möglich wäre.
SLE
Systemischer Lupus erythematodes (SLE)
Der systemische Lupus erythematodes (SLE) ist eine Autoimmunerkrankung mit einer Vielzahl an möglichen Symptomen.
Die genaue Ursache der Erkrankung ist unklar, es dürfte jedoch ein Zusammenspiel von genetischen Faktoren und Umwelteinflüssen (Sonnenlicht, bestimmte Virusinfektionen, Medikamente, …) verantwortlich sein. Frauen erkranken ca. 9-10 mal häufiger als Männer.
Symptome:
Die Krankheit kann sich mit sehr vielen unterschiedlichen Symptomen präsentieren, somit ist eine Diagnostik oftmals schwierig. Nachfolgend sind einige mögliche Symptome eines SLE angeführt, wobei jedoch praktisch nie alle Symptome vorliegen.
- Allgemeinsymptome: Fieber, Müdigkeit, Antriebslosigkeit, Gewichtsverlust.
- Haut: typische ist eine schmetterlingsförmige Rötung im Gesicht (Schmetterlingserythem), Sonnenempfindlichkeit, diverse Hautveränderungen, offene Stellen im Mund, Haarausfall.
- Lunge: am häufigsten Rippenfellentzündung (Pleuritis), seltener Entzündung des Lungengewebes.
- Gefäße: Raynaud-Syndrom, Lungenhochdruck.
- Gelenke/Muskulatur: Gelenksschmerzen oder Gelenksschwellungen, Muskelschmerzen
- Blutbild/Gerinnung: Blutkörperchen (Leukozyten oder Erythrozyten) und Blutplättchen (Thrombozyten) können vermindert sein. Wenn zusätzlich ein Antiphospholipid-Syndrom vorliegt besteht erhöhtes Thrombose- und Fehlgeburtsrisiko.
- Niere: Nierenentzündung (Lupus-Nephritis) ist die häufigste gefährliche Organbeteiligung.
- Herz: häufig Herzbeutelentzündung (Perikarditis), seltener Herzmuskelentzündung und Herzklappenentzündung.
- Nervensystem: Krampfanfälle, Kopfschmerz, Psychosen, Schädigung peripherer Nerven.
- Speichel- und Tränendrüsen: Augen- und Mundtrockenheit (Sicca-Symptomatik)
Diagnostik:
Die Diagnostik basiert einerseits auf der geschilderten Symptomatik des Patienten und zusätzlich auf Laboruntersuchungen. Bei den Laboruntersuchungen kommt vor allem der Bestimmung der antinukleären Antikörper (ANA) eine zentrale Bedeutung zu, da bei einem negativen Wert die Erkrankung weitestgehend ausgeschlossen werden kann. Jedoch ist bei einem positiven ANA-Wert keineswegs die Diagnose gesichert, auch vollkommen gesunde Menschen können zufällig einen erhöhten Wert haben. Zusätzlich gibt es noch charakterisierende Antikörper, nach denen gesucht wird. Nach Diagnosestellung werden Untersuchungen zur Abklärung einer möglichen Organbeteiligungen vorgenommen.
Therapie:
Sofern keine Kontraindikation besteht, erhalten alle Patienten mit diagnostiziertem SLE das Anti-Malariamittel Hydroxychloroquin, welches einerseits positiv auf die Krankheitsaktivität wirkt und andererseits die Schubhäufigkeit reduziert. Zusätzlich sollte konsequenter Sonnenschutz (UV-Schutz) betrieben werden, da dadurch ebenfalls Krankheitsschübe verhindert werden können. Das Rauchen sollte beendet werden, da auch hierbei ein negativer Einfluss auf die Krankheitsaktivität besteht.
In aktiven Krankheitsphasen ist der Einsatz von Glukokortikoiden (Kortison) oft unerlässlich. Im Verlauf sollten diese jedoch wieder abgesetzt oder zumindest deutlich reduziert werden. Damit dies gelingt, oder wenn schwerwiegende Organbeteiligungen bestehen, ist der Einsatz von anderen immunsupprimierenden Substanzen notwendig. Zusätzlich besteht die Möglichkeit einer Biologika-Therapie mit Belimumab oder Anifrolumab.
Weiters muss beachtet werden, dass Patient mit systemischem Lupus erythematodes ein deutlich erhöhtes kardiovaskuläres Risiko haben. Deshalb ist eine optimale Einstellung möglicher Begleiterkrankungen (Bluthochdruck, Diabetes mellitus, Hyperlipidämie,…) essenziell.
Verlauf und Prognose:
Die Erkrankung verläuft zumeist in Schüben. Durch verbesserte Therapieansätze lässt sich die Erkrankung in der Regel gut kontrollieren, und die Prognose hat sich dadurch entscheidend verbessert. Die meisten PatientInnen können unter einer entsprechenden Medikation ein normales Leben führen, regelmäßige Kontrollen sind jedoch wichtig.
Da zumeist junge Frauen von der Erkrankung betroffen sind, sollte auch das Thema Kinderwunsch besprochen werden. Eine Schwangerschaft ist für SLE-Patientinnen absolut möglich, es sollte jedoch zuvor der behandelnde Rheumatologe zugezogen werden, um eine optimale medikamentöse Einstellung zu finden. Ideal wäre die Planung der Schwangerschaft in einer stabilen Erkrankungsphase. Zusätzlich müssen eventuell Medikamente abgesetzt werden.
Sjögren Syndrom
Ursache:
Das Sjögren Syndrom ist eine Autoimmunerkrankung, welche sich in einer Entzündung von Speicheldrüsen und Tränendrüsen äußert. In den 30er Jahren des vorigen Jahrhunderts wurde die Erkrankung vom Augenarzt Henrik Sjögren beschrieben. Durch die Entzündung kann es zu Schwellungen der Speicheldrüsen, vor allem der Ohrspeicheldrüse kommen. In weiterer Folge vernarbt das Gewebe und produziert zu wenig Speichelflüssigkeit. Ähnliches passiert auch in den Tränendrüsen.
Symptome:
Die daraus resultierenden Symptome (Mund- und Augentrockenheit) sind jedoch nicht nur bei Sjögren Syndrom vorkommend, sondern auch Nebenwirkung von vielen Medikamenten, zum Beispiel gegen Depressionen, Ödeme, Bluthochdruck, Allergien, Parkinson, Schmerzen, Epilepsie usw. um nur einige zu nennen. Außerdem spüren Menschen gerade Mundtrockenheit bei verschiedenen Zuständen, wie trockener Luft, Flüssigkeitsmangel, Schnarchen, Rauchen, Stress und Angststörungen. Zudem gibt es verschieden Krankheiten welche mit Mundtrockenheit einhergehen, wie Erkältungen, beginnende Stoffwechselkrankheiten oder nach Bestrahlungen. Somit ist das Symptom Mundtrockenheit sehr unspezifisch und erfordert eine eingehende Beratung und nachfolgend auch Untersuchung durch den Hausarzt beziehungsweise verschiedener Fachärzte.
Häufige zusätzliche Symptome:
- bleierne Müdigkeit (Fatigue)
- Gelenksbeschwerden mit Schwellung, Rötung beziehungsweise Morgensteifigkeit
- Muskelschmerzen
- Hautsymptome wie Ausschlag, trockene oder juckende Haut
Diagnose:
Wenn Sie keine Medikamente nehmen, welche Mundtrockenheit verursachen können oder auch keine mit Mund/Augentrockenheit einhergehende Erkrankungen haben, sowie andere äußerliche Faktoren die zu Schleimhauttrockenheit führen ausschließen können, helfen folgende Fragen weiter:
Augentrockenheit
- Leiden Sie täglich unter Augentrockenheit seit mehr als 3 Monaten
- Haben Sie das Gefühl von Sand oder Fremdkörper in den Augen
- Benötigen Sie Tränenflüssigkeitsersatz mehr als 3x täglich
Mundtrockenheit
- Haben Sie seit mehr als 3 Monaten das Gefühl von Mundtrockenheit
- Leiden Sie unter Schwellung der Speicheldrüsen
- Müssen Sie etwas trinken, um ihr Essen schlucken zu können
Wenn Sie je eine Frage zu Augen und Mundtrockenheit mit Ja beantworten können, sollten Sie mit Ihrem Hausarzt über das Thema sprechen. Dieser wird dann entsprechende Laboruntersuchung, wie zum Beispiel ANA, anti Ro und anti La, Rheumafaktor und andere zielgerichtete Untersuchungen, wie Ultraschall der Speicheldrüsen, HNO- und Augenfachärztliche Untersuchung einleiten, und bei Verdacht auf Sjögren Syndrom einen Rheumatologen hinzuziehen.
Dieser wird, wenn sich die Diagnose bestätigt, auch feststellen, ob andere Organe, wie Niere, Nervensystem, Lunge, Lymphsystem oder Blut zusätzlich betroffen sind. Weiters wird er erheben, ob das Sjögren Syndrom Teil einer anderen rheumatischen Erkrankung wie Sklerodermie, Mischkollagenose, SLE oder rheumatoide Arthritis ist, also ein sekundäres Sjögren Syndrom darstellt. Außerdem kommt das Sjögren Syndrom häufig in Gesellschaft von anderen Erkrankungen, wie Lebererkrankungen oder Schilddrüsenerkrankungen, vor.
Therapie:
Leider gibt es derzeit noch keine spezifische Therapie des Sjögren Syndroms, aber für einige Manifestationen gibt es hilfreiche Therapiestrategien.
Wichtig sind Maßnahmen wie:
- Regelmäßiges Zähneputzen mit fluoridhaltiger Zahnpasta
- Regelmäßiger Zahnarztbesuch und Mundhygiene
- Regelmäßiges Trinken, um die Schleimhäute feucht zu halten
- Vermeidung von zuckerhaltigen Getränken
- Zuckerfreie Kaugummi regen die Speichelproduktion an
- Vermeidung von aktiv oder passiv Rauchen
- In Innenräumen auf ausreichende Luftfeuchtigkeit achten
- Meiden Sie Klimaanlagen
- Halten Sie sich viel in frischer Luft auf
- Schützen Sie Ihre Augen bei Zugluft oder Sonnenschein mit einer Brille
- Benützen Sie rückfettende Waschlotionen
- Gönnen Sie sich Pausen
Mit diesen Maßnahmen könne Sie ihre Symptome mildern und einigen Komplikationen vorbeugen.
Systemische Sklerose
Ursache:
Die systemische Sklerose (oder „Sklerodermie“) ist eine Autoimmunerkrankung, deren Ursache noch unklar ist. Im Wesentlichen kann es zu drei Phänomenen kommen, die viele verschiedene Organe betreffen und so unterschiedliche Beschwerden auslösen können:
- Entzündung
- Vermehrte Bildung von Bindegewebe („Fibrose“)
- Durchblutungsstörungen
Symptome:
Weil so viele Organe auf unterschiedliche Art und Weise betroffen sein können, leiden PatientInnen an diversen Symptomen, die anfangs oft nicht dieser Erkrankung zugeordnet werden, was eine genaue Diagnosestellung auch sehr schwierig macht. Zu den häufigsten Symptomen, die für diese Erkrankung auch sehr typisch ist, zählt eine Verdickung der Haut. Diese kann sich von den Händen bis über den ganzen Körper ausbreiten und zu Einschränkungen der Beweglichkeit führen.
Auch typisch ist eine Durchblutungsstörung der Finger oder Zehen, auch „Raynaud-Syndrom“ genannt. Bei kalten Temperaturen färben sich die Fingerspitzen weiß bzw. blau; falls dies sehr häufig auftritt, können Wunden an den Fingerspitzen entstehen.
Weitere Symptome sind z.B. Gelenksschmerzen, Atemnot, Sodbrennen, Schluckbeschwerden, Bauchschmerzen, Blähungen, Durchfall und Verstopfung, und vieles mehr.
Diagnose:
Da die Erkrankung so viele verschiedene Verläufe haben kann, ist es nicht leicht, eine Diagnose zu stellen. Bei passendem Beschwerdebild werden im Rahmen einer ersten Diagnostik spezielle Laborwerte (Autoantikörper) bestimmt und gezielte Untersuchungen wie z.B. eine Kapillarmikroskopie (zur Beurteilung der Durchblutung der Finger) durchgeführt.
Wenn schließlich die Diagnose einer systemischen Sklerose gestellt wurde, wird eine sehr genaue Durchuntersuchung vorgenommen, um herauszufinden, ob bestimmte Organe – wie z.B. das Herz, die Lunge, die Nieren – befallen sind.
Therapie:
Leider gibt es bis jetzt noch keine Heilung dieser Erkrankung. Man kann aber durch den Einsatz von Medikamenten die Erkrankung zum Stillstand bringen. Manchmal ist es auch ein langwieriger Prozess, bis man das passende Medikament gefunden hat.
Da so viele Organe betroffen sein können, werden die Patientinnen nicht nur rheumatologisch betreut, sondern auch durch Ärztinnen mit anderen Spezialisierungen wie Lungenheilkunde, Gastroenterologie, Kardiologie, Dermatologie und Nephrologie.
Sehr wichtig ist auch der Einsatz von Physiotherapie und Ergotherapie zum Erhalt der Beweglichkeit; Psychologinnen, Diätologinnen und andere Berufsgruppen aus dem Gesundheitssektor arbeiten in der Betreuung dieser Patientinnen regelmäßig zusammen.
Wertvolle Infos:
Da die Erkrankung sehr selten ist, wird die systemische Sklerose am besten in einem spezialisierten Zentrum betreut, wo viele verschiedene Berufsgruppen eingesetzt werden können.
Meistens ist das Auftreten eines Raynaud-Syndroms harmlos. Es macht aber auf jeden Fall Sinn, dies zumindest einmal bei einem Facharzt für Rheumatologie bzw. bei einem Gefäßspezialisten abklären zu lassen.
Myositis
Entzündlich-rheumatische Muskelerkrankungen (Myositis)
Eine entzündliche, immunologisch („autoimmun“) bedingte Schädigung der quergestreiften Muskulatur ist das Merkmal dieser seltenen Muskelerkrankungen.
Symptome:
Die Betroffenen schildern meist eine symmetrisch auftretende, zunehmende Muskelschwäche, besonders im Bereich der Oberarme-oder Oberschenkelmuskulatur, sodass z.B. Stiegen steigen erschwert ist. Zusätzlich finden sich teils typische Hautveränderungen und auch Gelenksschmerzen, Atembeschwerden und Schluckstörungen, und sogar Fieberschübe können auftreten.
Weitere Allgemeinsymptome wie Müdigkeit, rasche Erschöpfung und Gewichtsverlust sind ebenfalls häufig.
Meist können andere Gründe einer plötzlichen, unklaren Muskelschädigung, wie zum Beispiel Infektionen (z.B. Virusinfekte), neue Medikamente oder Muskelverletzungen schon durch eine gezielte Befragung des Patienten und den Symptomverlauf erkannt werden.
Diagnose:
Nach genauer Erhebung der Beschwerden des Patienten erfolgt meist eine Laboruntersuchung, bei der sich typischerweise deutliche erhöhte Muskelwerte (z.B Creatininkinase = „CK Werte“) zeigen und oft auch die Entzündungsparameter im Blut (z.B C-reaktives Protein = CRP) erhöht sind.
Bei Verdacht auf eine Myositis können mittlerweile weiterführend eine große Anzahl an Autoantikörpern aus dem Blut bestimmt werden, die für die weitere Unterscheidung der verschiedenen Krankheitsformen und auch deren Verlauf sehr hilfreich sein können.
Letztlich ist die Entnahme und Aufarbeitung einer Gewebeprobe aus der betroffenen Muskulatur (Muskelbiopsie) bei unklaren Befunden zur genauen Diagnosestellung sinnvoll.
Oft sind auch andere Organe wie Haut (z.B. Dermatomyositis), Lungengewebe oder auch Magen-Darmtrakt mitbetroffen, und manche Formen der Myositiden treten im Zusammenhang mit anderen rheumatischen Erkrankungen oder sogar mit bösartigen Tumorerkrankungen in Erscheinung.
Daher ist eine genaue, oft aufwendige Abklärung unerlässlich.
Therapie:
Therapeutisch steht am Beginn eine hochdosierte Therapie mit Glukokortikoiden zur raschen Symptomkontrolle im Vordergrund, jedoch sollte zeitlich zur Minimierung möglicher Nebenwirkungen eine kortisonsparende Behandlung mit immunmodulierenden Medikamenten (z.B. Methotrexat, Azathioprim u.a.) begonnen werden.
Bei Versagen dieser Therapien, dem Nachweis typischer Antikörper oder schwerwiegender Organbeteiligungen werden auch Biologikatherapien (z.B Rituximab) erfolgreich eingesetzt.
PMR (Polymyalgia rheumatica)
Die Polymyalgia (griechisch: polys= viel, myalgia = Muskelschmerz) rheumatica ist eine entzündlich rheumatische Erkrankung, die durch starke Schmerzen und Muskelsteifigkeit gekennzeichnet ist. Auch wenn der Name eine Muskelerkrankung nahelegt, handelt es sich bei der Polymyalgia rheumatica vornehmlich um Entzündungen im Bereich der die Gelenke umgebenden Weichteile (besonders Sehnen und Schleimbeutel).
Ursache:
Die Ursache der Erkrankung ist unklar, vermutet wird jedoch das Zusammenspiel genetischer Einflüsse und Umweltfaktoren, wie beispielsweise stattgehabte Infekte.
Auffällig ist hierbei besonders, dass die Symptome der Erkrankung fast ausschließlich nach dem 50. Lebensjahr auftreten und Frauen etwas häufiger betroffen sind.
Symptome:
Die Beschwerden beginnen meist rasch („wie über Nacht“) mit starker Morgensteifigkeit und Schmerzen im Bereich des Schultergürtels, besonders beider Oberarme, oft auch der Hüftregion und beiden Oberschenkeln.
Die Betroffenen schildern oft nächtliche Schmerzen und deutliche körperliche Einschränkungen durch eine starke Muskelsteifigkeit und damit verbundenen muskelkaterartigen Schmerzen.
Insbesondere in den Morgenstunden werden durch das erschwerte Heben der Oberarme alltägliche Dinge wie z. B. das Aufstehen, Anziehen oder auch nur das Kämmen der Haare zur Qual.
Auch Allgemeinsymptome wie Abgeschlagenheit, rasche Erschöpfung oder Gewichtsverlust erschweren den Alltag so sehr, dass die Betroffenen frühzeitig ärztliche Hilfe in Anspruch nehmen müssen.
Bis zu einem Fünftel der Patienten können Symptome einer assoziierten Entzündung großer Arterien z.B. im Schläfenbereich mit Sehstörungen aufweisen, was aufgrund der Gefahr eines bleibenden Sehverlustes einen „rheumatologischen Notfall“ darstellt.
(siehe Riesenzellarteriitis).
Diagnose:
Die Diagnose stellt der geschulte Arzt bzw. Rheumatologe durch das Erkennen der typischen
Symptome in Verbindung mit nahezu immer erhöhten Entzündungswerten, (Blutsenkungsgeschwindigkeit und C- reaktives Protein = CRP Wert) in einer Blutuntersuchung. Andere serologische Marker wie z. B. Rheumafaktoren oder Muskelwerte sind in der Regel unauffällig.
Da erhöhte Entzündungszeichen und erwähnte Allgemeinsymptome auch für andere, teils häufigere Erkrankungen wie z.B. Infekte oder auch Tumorerkrankungen typisch sind, müssen diese bei Verdacht unbedingt ausgeschlossen werden.
Therapie:
Die initiale Therapie der Wahl stellt nach wie vor die Gabe von Glucocorticoiden („Kortison“) dar, wobei bei der Polymyalgia rheumatica mittelhohe Dosen (z. B. Prednisolon 15mg/Tag) typischerweise zu einer dramatischen Verbesserung innerhalb weniger Tage, oft sogar von Stunden führt.
Leider ist jedoch bei zu rascher Beendigung der Kortisontherapie mit einem Wiederaufflammen der Erkrankung zu rechnen, sodass die Reduktion schrittweise über Monate erfolgen sollte. Dadurch ist jedoch das Risiko für begleitende Nebenwirkungen einer längerfristigen Kortikosteroid Therapie deutlich erhöht
Wichtig ist daher das frühe Erkennen und die Behandlung von Begleiterkrankungen wie Diabetes mellitus, Osteoporose und besonders einer manifesten Arteriosklerose.
Besonders in diesen Situationen sollte die frühzeitige Evaluierung und der Versuch anderer, Kortikoid freier Therapiealternativen mit den PatientInnen besprochen werden.
GZA (Giant zell artritis)
Riesenzellarteriitis (=RZA, engl.: Giant Cell Arteriitis = GCA; Arteriitis temporalis, auch Morbus Horton)
Dabei handelt es sich um eine entzündlich rheumatische Erkrankung, bei der eine Entzündung großer arterieller Gefäße zur Verdickung und Schädigung der Gefäßwand und Einschränkung des Blutdurchflusses führt. Folgen können Störungen der Durchblutung wichtiger Strukturen oder sogar ein Einreißen der Gefäßwand sein.
Ähnlich wie die Polymyalgia rheumatica tritt die RZA regelhaft zumindest nach dem 50. Lebensjahr (zumeist zwischen 70.-80. Lebensjahr) auf. Der Name stammt von typischen, großen, mehrkernigen Zellen, welche man in Gewebsproben betroffener Gefäße nachweisen kann.
Nach vornehmlich betroffener Gefäßregion unterscheidet man:
- einen kranialen („kopfbetonten“) Verteilungstyp mit typischem Befall der Schläfengefäße (=Arteriitis temporalis) und
- ein extrakraniales Befallsmuster mit Entzündung der Hauptschlagader (=Aorta) und großer, abgehender, arterieller Gefäße.
Symptome:
Typisch für einen Befall der Schläfengefäße sind Symptome wie neu auftretende starke Kopfschmerzen, Schmerzen beim Kauen oder plötzliche, oft einseitige Sehstörungen.
Letztere sind besonders gefürchtet und bedeuten einen rheumatologischen Notfall, da nur durch eine rasch eingeleitete, hochdosierte Glukokortikoid Therapie („Kortison“) das Risiko einer dauerhaften Erblindung reduziert werden kann.
Abgeschlagenheit, Nachtschweiß oder sogar Fieber unklarer Ursache sind typische Zeichen einer Riesenzellarteriitis, wobei die Entzündungsparameter des Blutes (C-reaktives Protein = CRP und Blutsenkungsgeschwindigkeit) regelhaft deutlich erhöht sind. Beschwerden einer Polymyalgia rheumatica (siehe oben) treten bei zirka der Hälfte der Patienten auf.
Therapie:
Die Therapie der Wahl ist eine hochdosierte Therapie mit Glukokortikoiden, um den entzündlichen Prozess rasch unter Kontrolle zu bringen. Aufgrund der Gefahr eines Wiederaufflammens der Erkrankung war oft eine teils jahrelange und nebenwirkungsreiche Kortisontherapie notwendig. Glücklicherweise zeigten rezentere Studien bei Anwendung von Biologikatherapien (besonders Interleukin 6-Rezeptor Hemmern) bei GZA Patienten eine hohe Wirksamkeit, und bewiesen zudem einen wichtigen, Kortison einsparenden Effekt bei Anwendung dieser modernen Medikamente.
Gicht - Arthritis urica
Ursache und Symptome:
Die Gicht ist eine häufige Stoffwechselerkrankung, bei der es durch Ablagerung von Harnsäurekristallen zu einer stark schmerzhaften Gelenksentzündung kommen kann. Die Entzündung im betroffenen Gelenk entsteht häufig über Nacht. Das Gelenk zeigt sich geschwollen, gerötet und bereits bei leichter Berührung sehr schmerzhaft. In den meisten Fällen (ca. 60%) tritt der erste Gichtanfall im Großzehengrundgelenk auf. Grundsätzlich kann die Harnkristallablagerung jedoch in jedem Gelenk und auch in anderen Körpergeweben zu entzündlichen Schäden führen.
Ursache für die Bildung von Harnsäurekristallen ist ein erhöhter Harnsäurespiegel im Blut (Hyperurikämie). Die häufigste Ursache einer Hyperurikämie ist eine verminderte Harnsäureausscheidung über die Niere, zusätzlich kann vermehrter Genuss Purin haltiger Lebensmittel die Harnsäureproduktion erhöhen. Liegt die Harnsäurekonzentration über längere Zeit über der Löslichkeitsgrenze (also der Konzentration, unter der Harnsäure verlässlich flüssig bleibt), kann es zur Bildung von Harnsäurekristallen kommen. Werden diese Kristalle von den körpereigenen Abwehrkräften entdeckt, kommt es zu einer starken entzündlichen Abwehrreaktion, dem akuten Gichtanfall, die meist 1-2 Wochen dauert. Bleibt die erhöhte Harnsäurekonzentration bestehen, kommt es in weiterer Folge meist wieder zur Bildung von Kristallen und zu weiteren schmerzhaften Anfällen.
Therapie:
Die Behandlung der Gicht besteht im Wesentlichen aus zwei Teilen:
Der erste Teil ist die Behandlung des akuten Gichtanfalls mit entzündungshemmenden Medikamenten, um die schwere Entzündung zu stoppen, Schaden zu verhindern und Schmerzen zu lindern. Beschleunigt durch Medikamente kann ein schmerzhafter Gichtanfall nach wenigen Tagen bereits wieder überwunden sein.
Auch wenn der Anfall dann vorbei ist, würden bei Weiterbestehen einer erhöhten Harnsäure sehr wahrscheinlich wieder neue Anfälle auftreten. Deswegen ist dann der zweite wichtige Teil der Behandlung notwendig, die dauerhafte Senkung der Harnsäure unter die Löslichkeitsgrenze. Mit dieser Therapie wird das ursächliche Problem behoben. Hierzu sind harnsäuresenkende Medikamente wie Allopurinol notwendig. Weiters soll auf eine gesunde Ernährung geachtet werden (viel Obst und Gemüse, wenig Fleisch, wenig oder kein Alkohol). Eine gesunde Ernährung ist wichtig, aber alleine leider nicht ausreichend, um die Harnsäure entsprechend zu senken.
Ist der Harnsäurespiegel einmal unter die Löslichkeitsgrenze gesenkt, können sich keine neuen Kristalle mehr bilden und alte Kristalle werden nach und nach aufgelöst. Bei der Auflösung der alten Harnsäureablagerungen kann es auch unter Therapie anfangs noch zu Gichtanfällen kommen, langfristig treten aber bei dauerhafter Einnahme des harnsäuresenkenden Medikaments verlässlich keine Gichtanfälle mehr auf und neue Gelenksschäden können verhindert werden.
Rheuma und Herzkreislauferkrankungen
Es ist bekannt, dass PatientInnen mit rheumatologischen Erkrankungen ein mindestens 50% höheres Risiko für Herz-Kreislauf-Erkrankungen (Herzinfarkt, Schlaganfall) im Vergleich zur gesunden Allgemeinbevölkerung haben.
Das liegt daran, dass Entzündungen, die in den Gelenken auftreten, sich auch auf die Blutgefäße auswirken können. Die Entzündungen können zu Veränderungen in den Blutgefäßen führen, was in weiterer Folge zu einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen führt.
Daneben spielen auch die klassischen Risikofaktoren wie Bluthochdruck, Diabetes mellitus, Nikotinkonsum und Übergewicht eine wichtige Rolle.
Im Hinblick auf dieses erhöhte Risiko gilt es gerade bei rheumatologischen PatientInnen potenziell modifizierbare Risikofaktoren im Auge zu behalten und gegebenfalls entsprechend zu therapieren.
Nicht zuletzt hat auch die Therapie der rheumatologischen Erkrankung einen wesentlichen Einfluss auf das kardiovaskuläre (= Herz- und Gefäßsystem betreffend) Risiko der PatientInnen.
Unbestritten ist der negative Einfluss einer lange andauernden Cortison-Therapie sowie einer langfristigen Einnahme von NSAR (nicht steroidale Antirheumatika, wie z.B. Ibuprofen, Diclofenac, Naproxen etc.).
Hier liegt es an den behandelnden ÄrztInnen, gemeinsam mit den PatientInnen eine erfolgreiche Basistherapie zu etablieren, um vor allem Cortison einzusparen.
Im Gegensatz dazu hat sich gezeigt, dass eine suffiziente Therapie mit modifizierenden Medikamenten wie Methotrexat und den entsprechenden Biologika, einen positiven Effekt auf das Herz-Kreislauf-Risiko haben.
Primär gilt es also, eine steroidfreie Remission der rheumatologischen Grunderkrankung anzustreben.
Darüber hinaus sollen jedoch auch etwaige klassische Risikofaktoren erkannt und entsprechend therapiert werden. Hier empfiehlt sich zumindest alle 3-5 Jahre ein entsprechender Check auf ebendiese.
Ergänzend spielen lebensstilmodifizierende Maßnahmen eine bedeutsame Rolle.
Eine adäquate Kontrolle des Blutdruckes sowie des Fettstoffwechsels (allen voran LDL-Cholesterin), mit gegebenenfalls entsprechender medikamentöser Therapie, ist ein wesentlicher Grundpfeiler in der Reduktion von Herzinfarkt- und Schlaganfall-Risisko.
PatientInnen selbst können einen erheblichen Beitrag zur Reduktion dieses Risikos leisten, indem sie aufhören zu rauchen, auf ausreichend Bewegung achten und bestehendes Übergewicht reduzieren.
Zusammenfassend lässt sich sagen, dass in erster Linie eine konsequente Therapie der Grunderkrankung zu verfolgen ist, dies im Optimalfall ohne langfristige Cortison-Einnahme.
Nicht minder relevant ist ein Erkennen und gegebenfalls Behandeln der oben erwähnten klassischen Risikofaktoren.
Besonders rheumatologische PatientInnen profitieren nachweislich von einer Lebensstiländerung wie Rauchstopp, Gewichtsabnahme und ausreichend Bewegung.
Osteoporose
Was ist Osteoporose?
Osteoporose ist eine chronische Erkrankung des Knochens. Es kommt es zu einer Verringerung der Knochenmasse und zu einer Verschlechterung der Knochenstruktur, sodass die Knochen leichter brechen.
Die Vorstufe der Osteoporose wird Osteopenie genannt.
Wie entsteht Osteoporose?
Der Knochen unterliegt einem ständigen Umbauprozess. Osteoporose entsteht, wenn der Körper nicht genügend Knochenmasse aufbauen kann oder diese zu schnell abgebaut wird.
Die Entstehung von Osteoporose wird durch verschiedene Faktoren begünstigt.
Dazu zählen:
- höheres Alter
- Genetik
- Lebensstil (Rauchen, Alkoholkonsum)
- hormonelle Veränderungen (nach der Menopause)
Frauen sind insgesamt häufiger betroffen als Männer.
Medikamente, die den Knochenabbau begünstigen gehören ebenfalls dazu.
Menschen mit chronisch entzündlichen Erkrankungen, wie zum Beispiel der rheumatoiden Arthritis, sind besonders häufig betroffen – einerseits durch die entzündliche Aktivität selbst, andererseits durch die häufige Einnahme von Glucocorticoiden („Cortison“).
Weiters leiden häufig Menschen mit Diabetes mellitus und COPD an Osteoporose.
Wie stellt der Arzt die Krankheit fest?
Es werden Risikofaktoren im Patientengespräch erfragt und mittels Rechner (z.B. FRAX) das Risiko für die Wahrscheinlichkeit, eine Fraktur in den nächsten 10 Jahren zu erleiden, erhoben. Im Falle des Verdachts auf Osteoporose wird meist eine Knochendichtemessung durchgeführt.
Tritt ein Knochenbruch bei bereits geringer oder fehlender Belastung auf, kann sofort eine Osteoporose festgestellt werden.
Wie wird Osteoporose behandelt?
Die Basistherapie besteht aus einer Vitamin D und Calciumeinnahme.
Der Arzt verschreibt eine medikamentöse Therapie angepasst an das individuelle Risiko des Patienten.
Krafttraining nach physiotherapeutischer Anleitung und eine Lebensstiländerung bei Risikofaktoren kann unterstützend wirken.
Schwangerschaft und Kinderwunsch
Schwanger trotz Rheuma? Ja, das geht!
Wer an Rheuma leidet, kann niemals Kinder bekommen? Diese Zeiten sind zum Glück vorbei. Dank der modernen Biologika-Therapie und der hohen Qualität der medizinischen Versorgung in Österreich gelingt es vielen Patientinnen mit rheumatischen Erkrankungen, einen Zustand der Remission oder einer niedrigen Krankheitsaktivität zu erreichen. Häufige Fragen sind „Darf ich überhaupt schwanger werden?“ oder „Welche Nebenwirkungen können meine Medikamente haben?“. Die wichtigsten Faustregeln im Überblick:
Der richtige Zeitpunkt
Ist die Krankheitsaktivität erhöht, ist die Dauer bis zur Konzeption bei Patientinnen mit rheumatoider Arthritis (RA) oft verlängert. Das gilt auch, wenn die Erkrankung symptomatisch mit NSAR oder Steroiden behandelt wird. Auch die Komplikationsrate in der Schwangerschaft, zum Beispiel durch Präeklampsie oder Frühgeburtlichkeit, steigt sowohl bei entzündlichen Gelenkserkrankungen als auch beim Systemischem Lupus Erythematodes (SLE), wenn die Krankheitsaktivität der Mutter vor der Konzeption erhöht war.1 Frauen mit einer gut eingestellten Erkrankung leiden außerdem weniger unter Erkrankungsschüben während der Schwangerschaft und im Wochenbett. Patientinnen mit aktiver Erkrankung oder kürzlich gestellter Diagnose sollten daher sicher verhüten und die Familienplanung in eine Phase der niedrigen Krankheitsaktivität oder Remission verschieben. Daher müssen bei Kinderwunsch teratogene Medikamente rechtzeitig beendet werden und auf sichere schwangerschafts-kompatible DMARDs (disease modifying antirheumatic drugs) umgestellt werden.
Beratung wirkt
Aus der Praxis wissen wir, dass Patientinnen mit Kinderwunsch oft dazu tendieren, ihre Medikamente abzusetzen – ob in Absprache mit der Hausärztin/dem Hausarzt oder eigenmächtig. Sie nehmen lieber starke Schmerzen und eine höhere Krankheitsaktivität in Kauf, um ihr ungeborenes Kind durch eine etwaige Medikamenteneinnahme nicht zu gefährden. Heute gilt jedoch als gesichert, dass diese Art der mütterlichen Aufopferungsbereitschaft kontraproduktiv für die Schwangerschaft und den Gesundheitszustand der werdenden Mutter sein kann.
Aus einer 2016 veröffentlichten Studie wissen wir, dass eine ärztliche Beratung für Patientinnen mit chronisch-entzündlichen Erkrankungen vor ihrer Schwangerschaft entscheidend ist. 2
Eine ärztliche Beratung zum Thema Familienplanung senkt sowohl die Schubrate der entzündlichen Erkrankung als auch die Wahrscheinlichkeit, ein Kind mit niedrigem Geburtsgewicht zur Welt zu bringen. Patientinnen, die sich vor ihrer Schwangerschaft ärztlich beraten ließen, haben außerdem ein größeres Vertrauen in die Sicherheit und Notwendigkeit der verordneten Basistherapeutika, nehmen ihre Folsäure konsequenter ein und verzichten häufiger auf Nikotin. 2
Persönliche Beratung in Wien
Antworten auf ihre Fragen erhalten betroffene Frauen zum Beispiel an den rheumatologischen Abteilungen der Klinik Hietzing und AKH Wien. Dort wird eine interdisziplinäre Sprechstunde für „Familienplanung bei entzündlich-rheumatischen Erkrankungen“angeboten. Beratungsgespräche erfolgen nach telefonischer Terminvereinbarung. Weitere Informationen finden Sie auf der Homepage der Österreichischen Gesellschaft für Rheumatologie und auf der Homepage des österreichischen Register für rheumatische Erkrankungen und Reproduktion).
Infobox: Wissenswertes für die Praxis
- Eine Schwangerschaft bei chronisch-entzündlichen Erkrankungen sollte gut geplant sein und in einer Phase mit niedriger Krankheitsaktivität beginnen.
- Bei hoher Krankheitsaktivität in der Phase der Empfängnis und während der Schwangerschaft sinkt die Wahrscheinlichkeit für eine erfolgreiche Schwangerschaft und ein gesundes Kind.
- Differenzieren Sie bei der Medikamenteneinnahme in der Schwangerschaft! Bei Medikamenten aus der roten Box (siehe unten) sollte eine sichere Verhütung erfolgen. Bei Kinderwunsch sollten diese teratogenen Medikamente rechtzeitig abgesetzt und durch sichere Alternativen ersetzt werden.
- NSAR wie Ibuprofen oder Diclofenac sind ab der 28. Schwangerschaftswoche zu vermeiden, da sie beim Fetus einen vorzeitigen Verschluss des Ductus arteriosus Botalli auslösen können. Vor der 28. Schwangerschaftswoche sind NSAR sichere Medikamente für Mutter und Kind.
- Die Steroid-Dosis („Cortison“-Dosis) sollte so gering wie möglich gehalten werden, da bei höheren Dosen das mütterliche Infektionsrisiko steigt. Ebenso kann eine dauerhafte Steroidtherapie einen Gestationsdiabetes oder einer Schwangerschafts-assoziierte Hypertonie begünstigen.
- Es gibt schwangerschafts-kompatible, sichere Medikamente zur Kontrolle der entzündlich-rheumatischen Erkrankung. Aus zahlreichen Registerstudien wissen wir, dass die Medikamente in der grünen Box (siehe unten) kein erhöhtes Fehlbildungs- oder Abortrisiko verursachen. Im Gespräch mit der Patientin muss eine sorgfältige Beratung erfolgen, denn eine hohe Krankheitsaktivität der rheumatischen Erkrankung kann zu Schwangerschaftskomplikationen wie Präeklampsie und Frühgeburtlichkeit führen. Daher sollen DMARDs in der grünen Box nicht leichtfertig abgesetzt werden.
- Bei Patientinnen mit erhöhtem Risiko für Schwangerschaftskomplikationen, etwa mit Lupus-Nephritis, sollte die Geburtsanmeldung in einem geburtshilflichen Zentrum für Risikoschwangerschaften erfolgen. Bei diesen Frauen können im zweiten und dritten Schwangerschafts-Drittel engmaschige Kontrollen der kindlichen Entwicklung nötig sein.
- Die meisten Kinder von Frauen mit entzündlichen Erkrankungen kommen gesund zur Welt. Motivieren sie die Patientin, in ihrem persönlichen Wirkungsbereich aktiv zu werden:
- Vor der Empfängnis mit der Folsäure-Einnahme beginnen. Bei vorangegangener Methotrexat-Therapie oder laufender Salazopyrin-Therapie: 5mg Folsäure täglich, da die handelsüblichen Schwangerschaftsvitamine nicht ausreichen.
- Andere kardiovaskulärer Risikofaktoren behandeln, etwa arterielle Hypertonie, Diabetes mellitus oder Adipositas.
- Unbedingt mit dem Rauchen aufhören!
- Regelmäßige körperliche Aktivität fördert eine gesunde Schwangerschaft!
Rheuma-Medikamente in der Schwangerschaft: Was die Forschung derzeit weiß
Muss ich meine Rheuma-Medikamente absetzen, wenn ich schwanger werden will? Viele Fachinformationen der Hersteller („Beipackzettel“) antworten oft pauschal: Ja. Doch diese Empfehlung beruht meist auf fehlenden Daten und nicht auf einem bewiesenen schädigenden Effekt für das Kind. Oft ignorieren die Fachinformationen zudem das potenzielle Risiko für die Mutter, wenn sie ihr Medikament absetzt und ihre Erkrankung unbehandelt bleibt. Daher wurde ein Konsens der österreichischen Fachgesellschaften für Gastroenterologie und Hepatologie sowie für Rheumatologie und Rehabilitation publiziert, der Empfehlungen zum Einsatz von DMARDs (disease modifying anti-rheumatic drugs) in der Schwangerschaft und Stillzeit enthält. 3
In der roten Box finden sich teratogene Medikamente, also solche, die zu einer erhöhten Fehlbildungs- oder Abortrate führen.
Zum Beispiel: Methotrexat ist teratogen (rote Box, siehe Tabelle) und muss drei Monate vor einer geplanten Schwangerschaft beendet werden. Zeitgleich sollte eine höhere Dosis Folsäure eingenommen werden (5 mg täglich) – bis zum Ende des ersten Schwangerschaftsdrittels.
Methotrexat erhöht das Risiko für kindliche Fehlbildungen auf 6,6 Prozent und jenes für Fehlgeburten auf 42 Prozent. Alternative Immunsupressiva, die während der Schwangerschaft eingenommen werden können, sind Sulfasalazin oder Hydroxychloroquin (grüne Box). 3 Bei Patientinnen mit hoher Krankheitsaktivität oder ungünstigen prognostischen Faktoren sind diese Medikamente manchmal nicht ausreichend. Dann kann in der Schwangerschaft auch die Gabe eines Biologikums notwendig sein. Biologika sind Derivate von Immunglobulinen, die gezielt das Krankheitsgeschehen beeinflussen. Dank ihrer Größe können sie während des ersten Schwangerschaftsdrittels, also dem Zeitpunkt der Organentstehung, nicht die Plazenta passieren. Ab dem zweiten Schwangerschaftsdrittel ändert sich das.
Die Biologika mit den meisten Erfahrungen in der Schwangerschaft sind TNF-Blocker, für die zahlreiche Studien vorliegen. In der systemischen Literaturrecherche der „EULAR task force Gruppe“ wurden 2.492 Schwangerschaften analysiert, während denen TNF-Blocker verabreicht wurden. Es konnte kein erhöhtes Risiko für Fehlgeburten oder angeborene Fehlbildungen festgestellt werden.1
Zu den TNF-Blockern zählen Infliximab, Etanercept, Adalimumab, Golimumab und Certolizumab. Ab der 20-24. Schwangerschaftswoche nimmt der diaplazentare Transport von Immunglobulinen (Ig) stetig zu. Daher sollte der Einsatz von Ig-basierten TNF-Blockern wie Infliximab, Adalimumab oder Etanercept ab diesem Zeitpunkt reevaluiert werden. Certolizumab unterscheidet sich strukturell von den anderen TNF-Blockern. Wie in mehreren Studien gezeigt werden konnte, sind die Transportraten von Certolizumab über die Plazenta während der gesamten Schwangersachft praktisch null. Daher ist dieser TNF-Blocker bei einem Therapiebeginn in der Kinderwunschphase oder während der Schwangerschaft zu bevorzugen.
Mögliche Risiken für in-utero exponierte Kinder sind Infektionen und Reaktionen auf Impfungen, insbesondere Lebendimpfstoffe. Daten zu ihrer Gesundheit nach einer Exposition im Mutterleib gibt es allerdings wenige. Die meisten Studien gibt es für Kinder im ersten Lebensjahr, deren Mütter während der Schwangerschaft TNF-Blockern erhielten. Diese Daten konnten kein erhöhtes Infektionsrisiko zeigen. Dennoch empfiehlt sich folgende Vorsichtsmaßnahme: Wenn die TNF-Blocker-Therapie bis zum Ende des zweiten Schwangerschaftsdrittels fortgeführt wurde, sollten Lebendimpfungen innerhalb der ersten sechs Lebensmonate vermieden werden. Wenn das Medikament während der gesamten Schwangerschaft verabreicht wurde, sollte bis zum Ende des ersten Lebensjahrs gewartet werden.
Zu den „neueren“ Biologika gehören unter anderem Rituximab, Belimumab, Abatacept, Tocilizumab, Ustekinumab, und Secukinumab. Für diese neuen Biologika liegen allerdings noch zu wenige Daten und Studien über ihre Sicherheit in der Anwendung während der Schwangerschaft vor. Ähnlich wie TNF-Blocker sind sie rund um Konzeption und Frühschwangerschaft als ungefährlich anzusehen, daher müssen sie erst bei positivem Schwangerschaftstest abgesetzt werden.
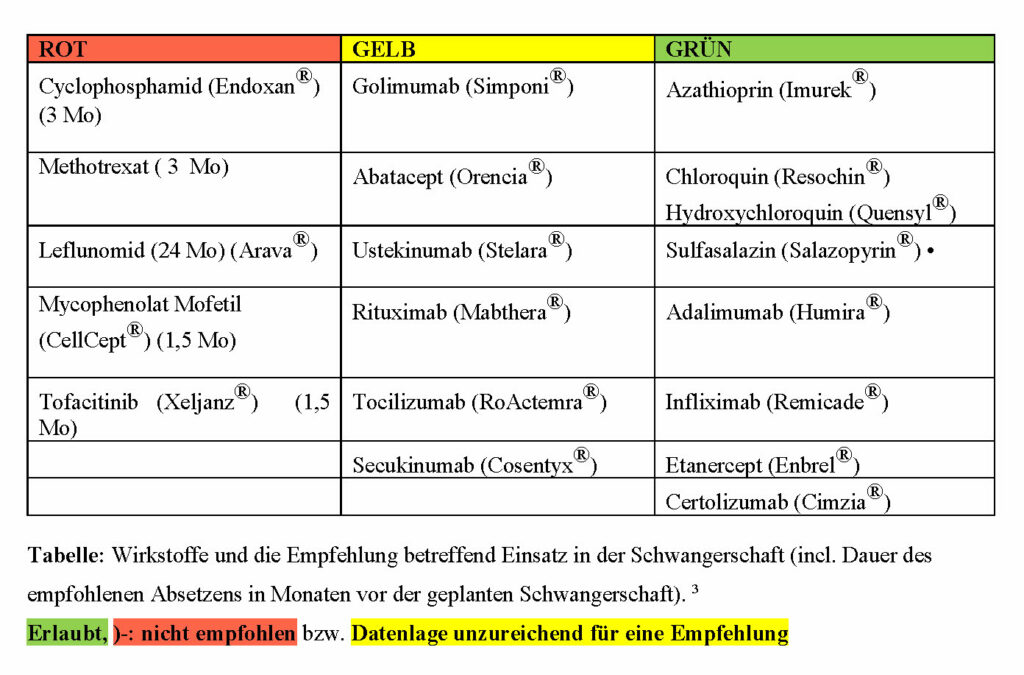
1 Gotestam Skorpen, C. et al. The EULAR points to consider for use of antirheumatic drugs before pregnancy, and during pregnancy and lactation. Ann Rheum Dis 75, 795-810, doi:10.1136/annrheumdis-2015-208840 (2016).
2 de Lima, A., Zelinkova, Z., Mulders, A. G. & van der Woude, C. J. Preconception Care Reduces Relapse of Inflammatory Bowel Disease During Pregnancy. Clin Gastroenterol Hepatol 14, 1285-1292 e1281, doi:10.1016/j.cgh.2016.03.018 (2016).
3 Puchner, A. et al. Immunosuppressives and biologics during pregnancy and lactation : A consensus report issued by the Austrian Societies of Gastroenterology and Hepatology and Rheumatology and Rehabilitation. Wien Klin Wochenschr 131, 29-44, doi:10.1007/s00508-019-1448-y (2019)
Quellenangabe Krankheitsbilder:
Erstellt November 2023 vom Ärzte-Team der 2. Medizinischen Abteilung – Klinik Hietzing – Zentrum für Diagnostik und Therapie rheumatischer Erkrankungen. Literatur bei den Verfassern.
Das Team der ÖRL bedankt sich für die freundliche Unterstützung und der guten Zusammenarbeit, beim gesamte Ärzte-Team der 2. Medizinischen Abteilung, Klinik Hietzing, Wolkersbergenstraße 1, 1130 Wien.
